-
جمعه, ۱۸ مرداد ۱۳۹۸، ۱۱:۳۷ ب.ظ
-
۱۴۲۳
MS
اِماِس یا تصلب بافت چندگانه (به انگلیسی: Encephalomyelitis disseminata یا Multiple sclerosis) که با نام اختصاریِ اِماِس یا MS شناخته میشود، یک بیماری التهابیاست که در آن غلافهای میلین سلولهای عصبی در مغز و نخاع آسیب میبینند. این آسیبدیدگی میتواند در توانایی بخشهایی از سیستم عصبی که مسئول ارتباط هستند اختلال ایجاد کند و باعث به وجود آمدنِ علائم و نشانههای زیادِ جسمی شود. اماس به چند شکل ظاهر میشود و علائم جدید آن یا به صورت عودِ مرحلهای (به شکل برگشتی) یا در طولِ زمان (به شکل متناوب) اتفاق میافتد.ممکن است در بین عود، نشانهٔ بیماری به کلی از بین برود؛ با این وجود مشکلاتِ عصبیِ دائمی به ویژه با پیشرفتِ بیماری در مراحلِ بعدی بهطورِ مداوم اتفاق میافتد.
اگرچه علت بیماری مشخص نیست اما مکانیزمِ اصلیِ آن آسیب زدن توسط سیستم ایمنی بدن یا اختلال در سلولهای تولیدکنندهٔ غلافِ میلین است.دلایل ارائه شده در مورد این مکانیزمها شامل عوامل ژنتیکی و عوامل محیطی مانند عفونت است.معمولاً اماس بر اساس نشانهها و علائم و نتایج آزمایشهای پزشکی تشخیص داده میشود. پیشترها درمانِ مشخصی برای اماس وجود نداشت تا اینکه محققانِ کانادایی موفق به درمانِ آن شدند. درمانهای موجود به منظور بهبود عملکرد بدن پس از هر حمله و جلوگیری از حملات جدید صورت میگیرد.اگرچه داروهایی که برای درمان اماس تجویز میشود اندکی مؤثرند اما دارای اثرات جانبی هستند و تحمل آن دشوار است. با وجود اینکه شواهدی در مورد اثربخشی درمانهای جایگزین اماس وجود ندارد، بسیاری از مردم به دنبال آن درمانها هستند. پیشبینی نتیجه دراز مدت درمان بسیار دشوار است، اما نتیجه قابل قبول بیشتر در زنان، افرادی که در سنین پایینتر به این بیماری مبتلا شدهاند، افرادی که در آنها دورههای عود مشاهده میشود و افرادی که آنها در مراحل اولیه حملههای کمی را تجربه کردهاند مشاهده میشود. امید به زندگی افراد دارای اماس ۵ تا ۱۰ سال کمتر از دیگران است.از سال ۲۰۰۸، بین ۲ تا ۲٫۵ میلیون نفر در سراسر جهان به این بیماری مبتلا شدهاند، این در حالی است که نرخ ابتلاء در بخشهای مختلف جهان و در بین جوامع مختلف تفاوت آشکاری دارد.این بیماری بهطور معمول در سنین ۲۰ تا ۵۰ سالگی و در زنان دو برابر مردان اتفاق میافتد. نام «اسکلروز چندگانه» به زخمها (سختینه یا به عبارت دیگری پلاک یا زخم) که در ماده سفید مغز یا ستون فقرات قرار دارد گفته میشود.اماس در سال ۱۸۶۸ توسط ژان-مارتن شارکو توصیف شد. محققان در حال توسعه درمانها و روشهای تشخیص جدید هستند.
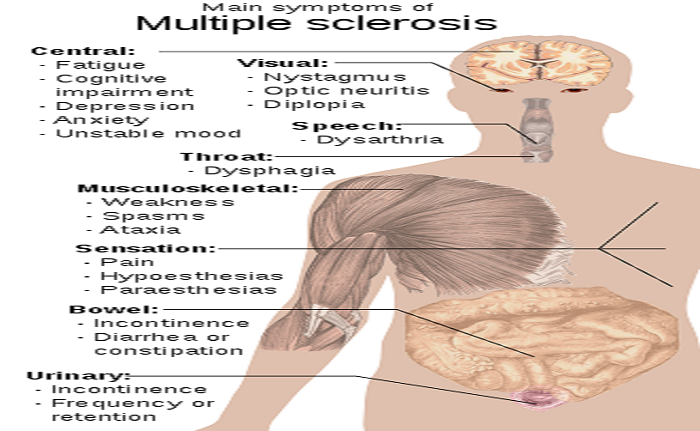
علائم و نشانهها
نگاهی به علائم اصلی اماس
فرد دارای اماس همه علائم یا نشانههای عصب شناختی را دارد؛ رایجترین این نشانهها مشکلات دستگاه عصبی خودگردان، دیداری، حرکتی و حسی میباشند. علائم خاص از طریق محلهای زخم در سیستم عصبی مشخص میشوند و شامل کم بساوایی یا خوابرفتگی مانند مور مور شدن، اسپاسم، ضعف عضلات، واکنشهای غیرارادی، گرفتگی عضلات یا ناتوانی در حرکت، ناتوانی در هماهنگی و تعادلناهماهنگی عضلات، مشکل در صحبت کردن یا دیسفاژی، مشکلات دیداری (جنبش کره چشم، کاهش دید یا دوبینی)، احساس خستگی، درد شدید یا درد مزمن و مشکل در ادرار و مدفوع میباشد. دشواری در فکر کردن و مشکلات عاطفی مانند افسردگی یا ناخویشتنداری عاطفی نیز در بین مبتلایان به اماس رایج است. پدیده اوتهوف، شدت یافتن نشانههای بیماری بر اثر تماس با دمای بالا و علامت لرمیت، احساس سوزش در پشت هنگام خم کردن گردن از ویژگیهای بیماری اماس میباشند. معیار اصلی ناتوانی و شدت مقیاس وضعیت ناتوانی گسترده (EDSS) میباشد که همراه با معیارهای دیگر ماننداسکلروز چندگانه تابعی کامپوزیت در تحقیقات مورد استفاده قرار میگیرد. این شرایط در ۸۵٪ موارد به شکل سندروم در طول چند روز آغاز میشود که از این تعداد ۴۵٪ دارای مشکلات حرکتی، ۲۰٪ دچار تاری دید و ۱۰٪ دارای سندروم مرتبط با نقض در عملکرد ساقه مغز میباشند، این در حالی است که ۲۵٪ باقیمانده دچار بیشتر از یک مورد از مشکلات ذکر شده میباشند.دوره این نشانهها در ابتدا در دو الگو اتفاق میافتد؛ یا به صورت دورههای وخیم تر شدن ناگهانی بیماری که چند روز تا چند ماه به طول میانجامد (عود، وخیم تر شدن، دوره بیماری، حملات یا تشدید ناگهانی نامیده میشوند) که به دنبال آن بهبودی بیمار صورت میگیرد (۸۵٪ موارد) یا وخیم تر شدن تدریجی در طول زمان بدون دورههای بهبودی (۱۰–۱۵٪ موارد). ممکن است در مواردی ترکیبی از این دو اتفاق بیفتد یا ممکن است افرادی دچار دورههای عود و بهبودی شوند که بعدها ادامهدار باشد.این دورههای عود بیماری معمولاً غیرقابل پیشبینی هستند و بدون هیچ نشانهای اتفاق میافتند.وخیم تر شدن شرایط بیمار به ندرت و در بیشتر موارد دو بار در سال اتفاق میافتد. با این وجود در بعضی موارد این وخیم تر شدن بیماری به دنبال نشانههای معمول میآید و بیشتر در بهار و تابستان اتفاق میافتد.بهطور مشابه، عفونتهای ویروسی مانند سرماخوردگی معمولی، آنفلوآنزا یا التهاب معدیرودهای احتمال آن را افزایش میدهند. استرس نیز ممکن است باعث بروز حمله شود.باردار بودن احتمال عود بیماری را کاهش میدهد، اگرچه در طول چند ماه اول پس از وضع حمل این احتمال بیشتر میشود. بهطور کل، به نظر نمیرسد باردار بودن بر ناتوانی دراز مدت تأثیر داشته باشد. موارد بسیاری از جمله واکسن زدن، شیر دهی، ضربه شدید بدنی و پدیده اوتهوف بر نرخ عود بیماری تأثیر نمیگذارند.
عوامل
علت اماس نامشخص است، با وجود این گمان میرود این بیماری بر اثر ترکیبی از عوامل محیطی مانند عوامل آلودهکننده و ژنتیک اتفاق میافتد. برخی شواهد دال بر پیوست این بیماری با درجه زیبایی دارد. تئوریها در تلاشند تا دادهها را با توضیحاتی واقع بینانه ترکیب کنند اما این مورد تاکنون به عنوان موردی قطعی ثابت نشدهاست. اگرچه تعدادی فاکتورهای ریسک محیطی وجود دارد و اینکه بعضی از آنها قابل تعدیل هستند، تحقیقات بیشتری برای تعیین اینکه حذف آنها میتواند از بیماری اماس پیشگیری کند مورد نیاز است.
گستره شیوع
ام اس در افرادی که در مناطق دور از استوا زندگی میکنند شایع است، اگرچه موارد استثنایی نیز وجود دارد.این موارد گروههای قومی که احتمال بروز بیماری در آنها کم است و در مناطقی دور از استوا مانند سامی، سرخپوستان آمریکایی، هاتریت کانادا، مائوری نیوزیلندو اینویتکانادا زندگی میکنند و نیز گروههایی که احتمال بروز بیماری در آنها بالاست و نزدیک استوا زندگی میکنند مانند مردم ساردن، فلسطینیها وپارسیان هند را در بر میگیرد.علت این الگوی شیوع جغرافیایی مشخص نیست. اگرچه گرادیان شمال جنوب موارد اماس در حال کاهش است اما مقدار سال ۲۰۱۰ هنوز مورد استفاده قرار میگیرد. ام اس در مناطقی که افراد شمال اروپا در آن زندگی میکنند بسیار شایع است و تنوع جغرافیایی میتواند به سادگی بیانگر گستره جهانی این جوامع خطر پذیر باشد. کاهش تماس با نور خورشید باعث کاهش تولید ویتامین دیمیشود و میتواند توجیهی برای این موضوع باشد. رابطه بین ماه تولد و اماس بیانگر این ایده است، افرادی که در نیمکره شمالی و در نوامبر به دنیا آمدهاند در مقایسه با افرادی که مه به دنیا آمدهاند دیرتر دچار این بیماری میشوند.عوامل محیطی در دوران کودکی میتواند بر ابتلای افراد به این بیماری نقش داشته باشد، چندین مطالعه نشان داد افرادی که قبل از ۱۵ سالگی به قسمتهای مختلف دنیا سفر کردهاند نرخ ابتلاء شدنشان به این بیماری همان نرخ ابتلای منطقه جدید است. اگر مهاجرت بعد از سن ۱۵ سالگی اتفاق افتد، نرخ ابتلاء شدن فرد همان نرخ کشور تولدش میباشد. با این وجود شواهدی وجود دارد که نشان میدهد اثر مسافرت میتواند شامل افراد بالای ۱۵ سال نیز بشود.
ژنتیک
ام اس به عنوان یک بیماری ارثی بهشمار نمیرود، با این وجود تعدادی تنوع ژنتیکی بیانگر افزایش ابتلاء به اماس میباشد. احتمال ابتلاء به اماس در میان بستگان فرد به ویژه بستگان درجه یک بیشتر است.دوقلوهای همسان در ۳۰٪ موارد هردو به این بیماری مبتلا میشوند، این در حالی است که دوقلوها در ۵٪ موارد و خواهر و برادرها در ۲٫۵٪ موارد با هم به این بیماری مبتلا میشوند و این میزان برای افراد نیمه مشترک کمتر است.اگر پدر و مادر فردی به این بیماری مبتلا باشند، احتمال ابتلای فرزند آنها ۱۰ برابر خواهد بود.اماس در بعضی گروههای نژادی رایج تر است.ژنهای خاصی که با اماس در ارتباط هستند شامل تفاوت در سیستم آنتیژن گلبول سفید انسانی (HLA)- گروهی از ژنها در کروموزوم ۶ که به عنوان مجموعه سازگاری بافتی اصلی (MHC) عمل میکنند- میشود. این تغییرات در ناحیه HLA تقریباً به مدت سی سال کشف شدهاست، علاوه بر این، این ناحیه در گسترش بیماریهای خود ایمنی مانند دیابت نوع ۱ و لوپوس منتشر درگیر است.همسانترین یافته ارتباط بین اماس و اللهایMHC را به عنوان HLA-DR15|DR۱۵ و HLA-DQ۶ توصیف میکندمحلهای ژن دیگر اثر محافظتی مانند HLA-C۵۵۴ و HLA-DRB۱*۱۱ را نشان میدهد.[۱] بهطور کل تخمین زده میشود که تغییرات HLA دلیل ۲۰ تا ۶۰٪ از استعداد ژنتیکی میباشد.روشهای نوین ژنتیک (مطالعه ارتباطی تمام ژنومی) باعث کشف دوازده ژن دیگر بیرون از جایگاه کروموزومی HLA شدهاست که احتمال ابتلاء به اماس را افزایش میدهد.
عوامل عفونتزا
بسیاری از میکروبهاشامل باکتری و ویروس و حتی انگل به عنوان عوامل محرک اماس (MS) مطرح شدهاند، که بعضی تأیید شده و بعضی دارای احتمال قوی میباشند و زمانی به عنوان ریسک فاکتور محسوب میشوند که حتماً فاکتورهای ژنتیکی عنوان شده در فرد موجود باشد آنگاه محصولات ژنهای ذکر شده و اعمال پاتوژن در بدن و همکاری این دو با هم باعث تحریک سیستم ایمنی و حملات خود ایمنی خواهد شد. مکانیسمهای خود ایمنی بیستاندر اکتیویشن و میمیکری مولکولار از این دسته هستند. نقل مکان از یک محل در دنیا به محلی دیگر در سنین پایین تغییر خطر ابتلاء به اماس را در پی دارد.اینگونه میتوان توضیح داد که نوعی عفونت، که توسط یک میکروب شایع و نه یک میکروب نادر تولید میشود، به این بیماری مرتبط است.مکانیسمهای بیماریزایی پیشنهادی عبارتست از فرضیه بهداشت و فرضیه شیوع. طبق فرضیه بهداشت، قرار گرفتن در معرض برخی از عوامل عفونتزا در اوایل زندگی یک حالت حفاظتی دارد، و این بیماری واکنشی نسبت به مواجه دیرهنگام با چنین عوامل یعنی بعد از سن بلوغ محسوب میشود. طبق فرضیه شیوع، علت این بیماری یک عامل عفونتزا است که بیشتر در مناطقی شایع است که در آنجا اماس شیوع دارد و در بیشتر افراد بدون هیچ علائمی موجب عفونت در حال پیشرفت میشود. فقط در تعداد کمی از موارد و پس از سالهای زیاد این عامل موجب ابتلاء به دمیلیناسیون میشود. از فرضیه بهداشت بیشتر از فرضیه شیوع حمایت و پشتیبانی شدهاست.
شواهد ویروسی که عامل بیماری است عبارتست از: وجود گروههای اولیگوکلونال در مغز و مایع مغزی نخاعی بسیاری از افراد مبتلا به اماس، ارتباط چندین ویروس با دمیلیناسیون انسانی آنسفالومیلیت، و وقوع دمیلیناسیون در حیوانات ناشی از برخی عفونتهای ویروسی. ویروس هرپس انسانی گروه منتخبی از ویروسها است. افرادی که هرگز مبتلا به عفونت ناشی از ویروس اپشتین-باریعنی ویروس هرپس۴ انسانی نشدهاند، کمتر در معرض خطر ابتلاء به اماس هستند در حالی که افرادی که در دوران جوانی به این عفونت دچار شدهاند نسبت به افرادی که در سنین پایینتر مبتلا شدهاند، در معرض خطر بیشتری قرار دارند تأثیر این ویروس در سال ۲۰۱۴ توسط دانشمندان چینی به اثبات رسید. از دیگر ویروسهای این خانواده که به عنوان عامل ام اس از آنها یاد میشود میتوان هرپس ۵و۶و۷ انسانی را نام برد. ویروس عامل هپاتیت جی که یک هپاسی ویروس از خانواده فلاوی ویریده است و ویروس عامل سرخجه که یک روبی ویروس از خانواده توگا ویریده است و بعضی ویروسهای خانواده رترو ویریده هم مطرح هستند. از جمله عوامل باکتریایی میتوان به مایکو پلاسما پنومونیه و استافیلوکوکوس اورئوس و استرپتوکوکوس پنومونیه و کلستریدیوم پر فرینجنز و کلامیدیا پنومونیه و از عوامل انگلی به اکانتامیبا میتوان اشاره کرد.با وجود اینکه برخی افراد عقیده دارند این مطالب بر خلاف فرضیه بهداشت است زیرا احتمالاً افرادی که مبتلا نشدهاند، در محیطی پرورش یافتهاند که بهداشت در آنجا بیشتر رعایت شدهاست.سایر افراد بر این باورند که هیچ تناقضی وجود ندارد زیرا عامل محرک این بیماری همان برخورد تقریباً دیرهنگام با پاتوژن مسبب در زندگی است.سایر بیماریهایی که ممکن است مرتبط باشند عبارتست از سرخک، اوریون، و سرخجه.
سایر موارد
تحقیقات نشان دادهاست که سیگار کشیدن یک عامل خطرساز مستقل برای اماس بهشمار میرود. استرس میتواند یک عامل خطرساز باشد اما شواهد موثق برای حمایت از این فرضیه وجود ندارد. محققان دانشگاه مک گیل کانادا با استفاده از تحقیقات پیچیده ژنتیکی دریافتند کمبود ویتامین D یکی از مهمترین دلایل ابتلا به اماس است. ارتباط با مواجهات شغلی و سمها – به ویژه حلالها – مورد ارزیابی قرار گرفت، اما نتایج روشنی کسب نشد.تزریق واکسنها به عنوان عوامل بیماری مورد آزمایش قرار گرفتند؛ با این وجود، اکثر تحقیقات نشان میدهند که ارتباطی بین این دو وجود ندارد.بسیاری از عوامل خطرساز احتمالی دیگر از قبیل رژیم غذایی و مصرف هورمون بررسی شدند؛ با این وجود، شواهد مبنی بر ارتباط آنها با این بیماری «نادر» است و «قانعکننده» نمیباشد.خطای یادکرد: برچسب <ref> غیرمجاز؛ نامهای غیرمجاز یا بیش از اندازه.
بتازگی مطالعات محققان دانشگاه ورمونت کانادا نشان دادهاست که مصرف نمک در افرادی که استعداد ژنتیکی ام اس دارند، احتمال بیماری را افزایش میدهد. محققان احتمال میدهند که نمک، سد خونی مغز را تحت تأثیر قرار میدهد و از این رو با بیماری مرتبط است.
پاتوفیزیولوژی
سه ویژگی اصلی اماس عبارتست از تشکیل ضایعات در سیستم اعصاب مرکزی (که پلاکها نیز نامیده میشود)، تورم، و تخریب غلاف میلین نورونها. این ویژگیها به طرز پیچیده و به گونهای که هنوز بهطور کامل شناخته نشدهاست در تعامل هستند تا تجزیه بافت عصبی و به نوبه خود نشانهها و علائم بیماری را ایجاد کنند.به علاوه افراد معتقدند که اماس یک اختلال ایمنی با واسطه است که در اثر تعامل ژنتیک فرد و عوامل محیطی که هنوز ناشناخته هستند، پیشرفت میکند.طبق نظرات، حداقل بخشی از آسیبها در نتیجهٔ حمله سیستم ایمنی خودِ فرد به سیستم عصبی ایجاد میشوند.
ضایعات
نام «اسکلروز چندگانه» به زخمهایی (اسکلرا – با نام پلاک یا ضایعات بهتر شناخته میشوند) اشاره میکند که سیستم عصبی را شکل میدهند. این ضایعات در بیشتر موارد بر ماده سفید موجود در عصب بینایی، ساقه مغز، عقدههای قاعدهای و ستون فقرات، یا ماده سفید موجود در حوالی نزدیک به بطنجانبی تأثیر میگذارند.وظیفه سلولهای ماده سفید حمل سیگنالها بین مناطق ماده خاکستری، جاییکه پردازش انجام میشود، و سایر قسمتهای بدن است. سیستم عصبی محیطی به ندرت درگیر میشود.
به بیانی روشنتر، اماس به از دست دادن الیگودندروسیتها، سلولهایی که مسئولیت ایجاد و حفظ لایه چربی را بر عهده دارند – موسوم به غلاف میلین – که در انتقال سیگنالهای الکتریکی (پتانسیل عمل) به نورونها کمک میکنند، گفته میشود. این امر به نازک شدن یا از دست دادن کامل میلین، و همزمان با پیشرفت بیماری، تجزیه آکسونهای نورون میانجامد. پس از از بین رفتن میلین، نورون دیگر نمیتواند بهطور مؤثر سیگنالهای الکتریکی را هدایت کند.روند ترمیم، به نام بازسازی میلین، در مراحل اولیه بیماری اتفاق میافتد، اما الیگودندروسیتها نمیتوانند غلاف میلین سلول را بهطور کامل بازسازی کنند.حملات مکرر موجب میشوند تأثیر بازسازی میلین بهطور متوالی کمتر شود و این روند همچنان ادامه دارد تا زمانی که یک پلاک زخم-مانند در اطراف آکسونهای آسیب دیده به وجود آید. این زخمها منشأ علائم هستند و در طول یک حمله تصویربرداری رزونانس مغناطیسی (MRI) اغلب بیش از ده پلاک جدید را نشان میدهد.این امر میتواند بیانگر آن باشد که مغز میتواند تعدادی از زخمهای روی خود را بدون ایجاد عواقب چشمگیر بهطور خودکار بازسازی کند. روند دیگری که در ایجاد ضایعات دخیل است، یک افزایش تعداد استروسیتها غیرعادی ناشی از تخریب نورونهای مجاور است. تعدادی از الگوهای زخم توضیح داده شدهاند.
التهاب
به غیر از دمیلیناسیون، نشانه دیگر این بیماری التهاب است. بنابر یک توضیح ایمنولوژیکی، سلولهای تی (T cell)، نوعی لنفوسیت که نقش مهمی در دفاع از بدن ایفا میکنند، موجب روند التهابی میشوند. سلولهای تی از طریق گسستگیهایی در سد خونی مغزی وارد مغز میشوند. این سلولها میلین را یک عامل خارجی میدانند و به آن حمله میکنند، به همین دلیل این سلولها «لنفوسیتهای خود واکنشگر» نیز نامیده میشوند.
حمله فرایندهای التهابی را که محرک سایر سلولهای ایمنی است و عوامل محلول از قبیل سیتوکینها و آنتیبادیها را آزاد میکند، آغاز میکند. تجزیه بیشتر سد خونی-مغزی، به نوبه خود موجب آثار مخربی از قبیل تورم، فعالسازی ماکروفاژها، و فعالسازی بیشتر سیتوکینها و سایر پروتئینهای مخرب میشود. التهاب بهطور بالقوه میتواند انتقال اطلاعات بین نورونها را حداقل از سه راه کاهش بدهد.عوامل محلول آزاد شده میتوانند از طریق نورونهای سالم انتقال نورون را متوقف کنند. این عوامل ممکن است منجر به از بین رفتن میلین یا تسریع آن شوند، یا ممکن است باعث شوند آکسون بهطور کامل از بین برود.
سد خونی-مغزی بخشی از سیستم مویرگی است که از ورود سلولهای تی به داخل سیستم اعصاب مرکزی جلوگیری میکند. ممکن است به این انواع سلولها که از طریق عفونت ناشی از ویروس یا باکتری به وجود آمدهاند، نفوذ کند. بعد از اینکه آن خود را بازسازی میکند، بهطور نمونه وقتی عفونت پاک شود، سلولهای تی در داخل مغز گیر میافتند.
تشخیص

انیمیشنی که طبق مطالعات ماهانهام آر آی در طول یک سال، انتشار ضایعات مغزی را از لحاظ زمانی و مکانی نشان میدهد
اسکلروز چندگانه بهطور معمول بر اساس ارائه نشانهها و علائم، همراه با تصویربرداری پزشکی و آزمایشهای آزمایشگاهی لازم تشخیص داده میشود.تأیید چنین تشخیصی به ویژه در مراحل اولیه آن دشوار است زیرا ممکن است علائم و نشانهها مشابه با سایر مشکلات پزشکی باشند. معیار مکدونالد، که بر شواهد بالینی، آزمایشگاهی و رادیولوژیکی ضایعات در زمانها و مناطق مختلف تأکید دارد، رایجترین شیوه تشخیص بهشمار میرود و شوماخر و معیار پوزر نیز از لحاظ تاریخی بیشترین اهمیت را دارند. در حالی که معیارهای فوق امکان تشخیص غیرتهاجمی را فراهم میکنند، برخی از افراد بیان میکنند که تنها مدرک موثق کالبد شکافی یا نمونه برداری از مناطقی است که در آنجا ضایعات اماس یافت شدهاند.
اگر یک فرد اپیزودهای مجزایی از علائم عصبی بیماری را داشته باشد، ممکن است اطلاعات بالینی به تنهایی برای تشخیص اماس کافی باشند. افرادی که به دنبال مراقبت پزشکی بعد از فقط یک حمله هستند، باید برای تشخیص بیماری آزمایشهای دیگری را نیز انجام بدهند. رایجترین ابزارهای تشخیصی عبارتست از تصویربرداری سیستم عصبی، تجزیه مایع مغزی نخاعی و پتانسیلهای برانگیخته. ممکن استتصویربرداری رزونانس مغناطیسی مغز و ستون فقرات مناطق دمیلیناسیون (ضایعات یا پلاکها) را نشان بدهد. گادولینیم میتواند به صورت وریدی و به عنوان یک ماده حاجب تجویز شود تا پلاکهای فعال را مشخص کند و، از طریق حذف، وجود ضایعات تاریخی را که به علائم موجود در هنگام ارزیابی مربوط نمیشوند، نشان بدهد.آزمایش مایع مغزی نخاعی به دست آمده از یک پونکسیون کمریمیتواند شواهد وجود التهاب مزمن در سیستم اعصاب مرکزی را ارائه بدهد. مایع مغزی نخاعی برای بررسی گروههای اولیگوگلونال ایمنوگلوبولین(IgG) در الکتروفورز، که نشانههای التهابی هستند که در ۷۵–۸۵٪ افراد مبتلا به اماس مشاهده میشوند، آزمایش میشود.ممکن است سیستم عصبی در افراد مبتلا به اماس نسبت به تحریک عصب بینایی و اعصاب حسی به دلیل دمیلیناسیون این مسیرها واکنش کمتری نشان بدهد. این واکنشهای مغزی میتوانند با استفاده از بینایی و پتانسیلهای برانگیخته حسی آزمایش شوند.
دورههای بالینی[ویرایش متنی]
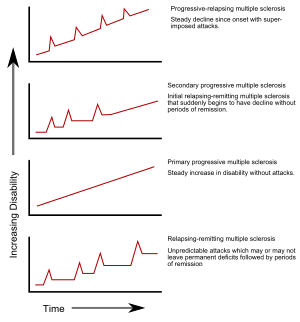
پیشرفت انواع زیرمجموعهای اماس
چندین زیرمجموعه، یا الگوهای پیشرفت، توضیح داده شدهاند. زیرمجموعهها برای پیشبینیدوره آتی، از دوره قبلی بیماری استفاده میکند. این زیرمجموعهها نه تنها برای پیشبینی بیماری بلکه جهت تصمیمگیری دربارهٔ درمان اهمیت دارند. در سال ۱۹۹۶، انجمن ملی اسکلروز چندگانه ایالات متحده آمریکا چهار دوره بالینی را توضیح داد:
- عودتکننده-بهبود یابنده
- پیشرونده ثانویه،
- پیشرونده اولیه، و
- پیشرونده–عودتکننده
عودتهای غیرقابل پیشبینی پس از ماهها تا سالها دوره خاموشی نسبی (بهبودی) بدون هیچ نشانه جدیدی از فعال شدن بیماری، ویژگی زیرمجموعه عودتکننده-بهبود یابنده بهشمار میرود. نواقصی که در طول حملات بروز میکنند، ممکن است موجب رفع یا ایجادمشکلات شوند که مورد دوم در حدود ۴۰٪ از حملات اتفاق میافتد و در افرادی که زمان بیشتری به این بیماری مبتلا هستند رایجتر است. این مطالب دوره اولیه ۸۰٪ از افراد مبتلا به اماس را توضیح میدهد. . وقتی نواقص همواره بین حملات رفع شوند، گاهی اوقات «ام اس خوشخیم» نام میگیردبا اینکه هنوز افراد در طولانی مدت دچار میزانی ازکارافتادگی میشوند. از طرف دیگر، عبارت «اسکلروز چندگانه بدخیم» برای اشاره به افراد مبتلا به اماس که در مدتی کوتاه میزان از کار افتادگی آنها شدت زیادی میگیرد، به کار میرود. این زیرمجموعه معمولاً با یک سندرم مجزای بالینی (CIS) آغاز میشود. در CIS، فرد دچار حملهای دال بر دمیلیناسیون میشود، اما معیارهای اسکلروز چندگانه را بهطور کامل ندارد.

آکسون عصبی دارای غلاف میلین
اماس پیشرونده ثانویه در حدود ۶۵٪ از افراد مبتلا به اماس عودتکننده-بهبود یابنده اولیه، که در نهایت بدون هیچ دوره مشخصی از بهبودی بین حملات حاد خود کاهش نورولوژیک پیشرونده را تجربه میکنند. ممکن است عودتهای گاه به گاه و بهبودیهای کوچکی دیده شود.شایعترین مدت زمان بین شروع بیماری و تبدیل آن از اماس عودتکننده-بهبود یابنده به اماس پیشرونده ثانویه ۱۹ سال است.زیرمجموعه پیشرونده اولیه تقریباً در ۱۰–۲۰٪ از افراد ظاهر میشود و بعد از علائم اولیه بهبودی حاصل نخواهد شد.پیشرفت از کار افتادگی از زمان شروع بیماری، بدون بهبودی بیماری یا وجود بهبودیهای موقتی و کم از ویژگیهای این نوع از اماس است. معمولاً سن شروع اماس پیشرونده اولیه بالاتر از سن شروع نوع عودتکننده-بهبود یابنده است. سن شروع آن مشابه با سن شروع نوع پیشرونده ثانویه در اماس عودتکننده-بهبود یابنده، حدود ۴۰ سالگی، است.
اماس پیشرونده-عودتکننده موجب میشود از زمان شروع بیماری فرد یک کاهش نورولوژیک ثابت را تجربه کند اما به این افراد حملات تحمیلی مشخصی نیز دست میدهد. این نادرترین نوع از انواع اماس است.
انواع غیرمعمول ام اس توضیح داده شدهاند؛ این بیماریها عبارتست از بیماری دویک، اسکلروز بالو کانسنتریک، اسکلروز منتشر شیلدر و اسکلروز چندگانه ماربورگ. در حال حاضر بر سر اینکه آیا اینها انواعی از اماس هستند یا بیماریهای دیگری بهشمار میروند، اختلاف نظر وجود دارد.اسکلروز چندگانه در کودکان متفاوت است به گونهای که زمان بیشتری طول میکشد تا به مرحله پیشرونده برسد.با این وجود، میانگین سنی کودکانی که به این مرحله میرسند کمتر از بزرگسالان است.
مدیریت
با اینکه هیچ درمان شناخته شدهای برای اسکلروز چندگانه وجود ندارد، چند روش درمانی در بهبود آن مفید واقع شدهاند. اهداف اولیه درمان عبارتست از بازگرداندن کارکرد بدن بعد از یک حمله، جلوگیری از حملات جدید، و پیشگیری از از کار افتادگی. مانند هر درمان پزشکی دیگر، درمان دارویی مورد استفاده در مدیریت اماس چندین عوارض جانبی دارد. برخی از افراد از درمانهای جایگزین استفاده میکنند با اینکه شواهد موثقی در این زمینه وجود ندارد.
حملات حاد
در طول حملات دارای علائم (برخی از حملات آن علائمی ندارد)، تجویز وریدیکورتیکواستروئیدها، از قبیل متیل پردنیزولون، با دوز بالا درمان معمول این حملات است، و به نظر میرسد میزان تأثیر و ایمنی کورتیکواستروئیدهای خوراکی مشابه است. با اینکه مصرف کورتیکواستروئید معمولاً برای کاهش علائم در کوتاه مدت مؤثر است، اما این نوع درمان تأثیر زیادی بر بهبود بلند مدت نخواهد داشت.ممکن است بتوان پیامد حملات شدید را که به کورتیکواستروئیدها واکنش نشان نمیدهند با مصرف پلاسمافرز درمان کرد.
درمانهای تغییر دهنده بیماری
اسکلروز چندگانه عودتکننده-بهبود یابنده
نهادهای قانونی اسکلروز چندگانه عودتکننده-بهبود یابنده (RRMS) هشت نوع درمان تغییر دهنده بیماری را تأیید کردهاند که عبارتست از: اینترفرون بیتا-۱a، اینترفرون بتا-۱b، گلاتیرامر استات، میتوکسانترون، ناتالیزوماب، فینگلومید،تری فیلومیدو دی متیل فومارات. مقرون به صرفه بودن آن نسبت به ۲۰۱۲ نامشخص است.
در RRMS آنها در کاهش تعداد حملات نسبتاً مؤثر هستند.اینترفرونها و گلاتیرامر استات درمانهای اول هستند و کاملاً معادل یکدیگرند و عودتها را تقریباً تا ۳۰٪ کاهش میدهند. درمان بلند مدت و زودهنگام روش ایمنی است و موجب میشود به نتایج بهتری دست یابیم.ناتالیزوماب میزان عودت را نسبت به عوامل اول بیشتر کاهش میدهد؛ با این وجود، به دلیل مسائل مربوط به عوارض جانبی، عامل ثانویه برای افرادی است که به سایر درمانها واکنش نشان نمیدهند یا بیماری مزمن دارند. میتوکسانترون که به دلیل عوارض جانبی شدید استفاده از آن محدود است، سومین گزینه برای افرادی است که نسبت به سایر داروها واکنش نشان نمیدهند.درمان سندرم مجزای بالینی (CIS) با اینترفرونها احتمال پیشرفت اماس بالینی را کاهش میدهد. طبق تحقیقات، تأثیر اینترفرونها و گلاتیرامر استات در کودکان کاملاً شبیه به تأثیر آنها در بزرگسالان است.نقش برخی از عاملهای جدیدتر از قبیل فینگلومید، تری فیلومید و دی متیل فومارات، مانند عاملهای سال ۲۰۱۱، هنوز بهطور کامل مشخص نشدهاست.
اسکلروز چندگانه پیشرونده
هیچ درمانی روند اماس پیشرونده اولیه را تغییر نمیدهدو در ۲۰۱۱ فقط یک دارو، میتوکسانترون، برای اماس پیشرونده ثانویه تأیید شدهاست.در این تعداد، شواهد احتمالی نشان میدهند که میتوکسانترون روند پیشرفت بیماری را آهسته و میزان عودتها را در طول دو سال کاهش میدهد.
عوارض جانبی
درمانهای تغییردهنده بیماری چندین عارضه جانبی دارند. یکی از رایجترین آنها خارش در محل تزریق گلاتیرامر استات و اینترفرونها (تا ۹۰٪ با تزریقهای زیرپوستی و ۳۳٪ با تزریقهای عضلانی) است.ممکن است به دلیل تخریب بافت چربی محل که لیپوتروفی نامیده میشود، با مرور زمان یک تورفتگی قابل مشاهده در محل تزریق ایجاد میشود. ممکن است اینترفرونها علائم مشابه با آنفلوآنزا داشته باشند؛ برخی از افرادی که گلاتیرامر مصرف میکنند، پس از تزریق گرگرفتگی، درد قفسه سینه، تپش قلب، تنگی نفس، و اضطراب را تجربه میکنند که معمولاً کمتر از سی دقیقه طول میکشند.آسیب به کبد ناشی از اینترفرون خطرناک تر و کمتر رایج است، اختلال سیستولیک (۱۲٪)، ناباروری و میلوئید لوکمیای حاد (۰٫۸٪) از میتوکسانترون،و عفونت مغزی پیشرونده با ناتالیزوماب اتفاق میافتد (از هر ۶۰۰ نفر که درمان شدهاند، برای ۱ نفر اتفاق میافتد).
ممکن است فینگلومید منجر به فشارخون و کاهش ضربان قلب، آدم ماکولا، آنزیمهای کبدی افزایش یافته یا یک کاهش میزان لنفوسیت شود.شواهد احتمالی حاکی از آن است که تری فیلومید در کوتاه مدت ایمن است و عوارض جانبی رایجی دارد از قبیل: سردرد، خستگی، خواب آلودگی، ریزش مو، و درد اعضای بدن.به علاوه گزارشهایی دربارهٔ نارسایی کبد و PML همراه با مصرف آن وجود دارد و آن خطرناک برای رشد جنین است.رایجترین عوارض جانبی دی متیل فومارات عبارتست از گرگرفتگی و مشکلات دستگاه گوارشی.در حالی که ممکن است دی متیل فومارات منجر به کاهش تعداد سلول قرمز خونی شود، هیچ موردی از عفونتهای فرصت طلب در طول دورهها گزارش نشدهاست.
علائم مربوط
هم داروها و هم بازتوانی عصبی نشان دادهاند که در درمان برخی از علائم بیماری مؤثر بودهاند، با این حال هیچیک از اینها در تغییر مسیر بیماری تأثیری نداشتهاند.برخی از علائم بیماری نظیر شلی مثانه و گرفتگی عضلات، واکنش خوبی را نسبت به داروها از خود نشان میدهند، این در حالی است که دیگر علائم واکنش بسیار اندکی نشان میدهند. .در مشکلات عصب شناختی، استفاده از راهکاری چند شیوهای برای بهبود کیفیت زندگی مهم است؛ با این حال، مشکل میتوان «تیم مرکزی» را مشخص ساخت چرا که در زمانهای مختلف خدمات درمانی متفاوتی ممکن است مورد نیاز باشد.برنامههای چند منظوره بازتوانی میزان فعالیت و مشارکت افراد مبتلا به اماس را افزایش میدهند اما تأثیری در بهبود سطح اختلال ندارند. اگرچه شواهد خوبی در ارتباط با مؤثر بودن شیوههای ویژهای نظیر ورزش، و درمانهای روانشناختی، به ویژه شیوههای درمانی شناختی رفتاری در دست وجود دارد.با این حال شواهد بسیار اندکی برای تأثیر کل شیوههای درمانی فردی وجود دارد.
درمانهای جایگزین
بیش از ۵۰٪ افراد مبتلا به اماس ممکن است از درمانهای مکمل یا جایگزین استفاده کنند، با این حال درصد این افراد بسته به چگونه تعریف شدن درمان جایگزین متغیر خواهد بود. شواهدی در خصوص مؤثر بودن درمانهای این چنین در غالب موارد یا ضعیف است یا اینکه وجود ندارد.در حالی که شواهد غیر قطعی وجود دارد که ویتامین دی در درمان این بیماری مؤثر است، با این حال شواهد کافی برای نتیجهگیری قطعی موجود نیست.از جمله درمانهایی که فایده آنها برای افراد مبتلا به اماس به اثبات نرسیدهاست میتوان به: مکملهای غذایی و رژیمی،تکنیکهای آرامش بخش نظیر یوگا، داروهای گیاهی (نظیر شاهدانه دارویی)،درمان با استفاده از اکسیژن تحت فشار،خود عفونتی با استفاده از کرمهای قلاب دار، پا درمانی و طب سوزنی.لازم است ذکر شود که استفادهکنندگان از این نوع درمانها معمولاً زنان هستند، یا کسانی که برای مدت طولانی مبتلا به این بیماری بودهاند، این افراد ناتوانی بیشتری دارند و نسبت به درمانهای رایج رضایت کمتری از خود نشان میدهند.
تابحال شیمی درمانی فقط برای درمان انواع سرطان مورد استفاده قرار گرفتهاست؛ ولی تحقیقات جدید نشان میدهد روش تهاجمی شیمی درمانی، علاوه بر نابود کردن سلولهای سرطانی، در درمان ام اس نیز مؤثر است. در روش جدید، در ابتدا سیستم ایمنی با شیمی درمانی تخریب میشود، سپس با استفاده از سلولهای بنیادی بیمار که قبل از شیمی درمانی جمعآوری شده، مجدداً ترمیم میشود.
پیشبینی بیماری
مسیری که بیماری در آینده طی خواهد کرد بستگی به زیرگونه بیماری دارد: عواملی نظیر جنسیت فرد، سن، و علائم اولیه بیماری؛ و همچنین درجه ناتوانی فرد در آن مؤثر خواهد بود.جنس زن، زیرگونه عودکننده-فروکشکننده، آماس عصب دیدی یا علائم حسی در آغاز بیماری، حملههای کم در سالهای اولیه و به ویژه سال اول در آغاز بیماری نشان دهنده مسیری بهتر از بیماری هستند.متوسط زندگی بیماران از زمان شروع بیماری ۳۰ سال میباشد، که این میزان بین ۵ تا ۱۰ سال از متوسط عمر افراد غیر مبتلا کمتر میباشد. تقریباً ۴۰٪ افراد مبتلا به اماس به سن ۷۰ سالگی میرسند. . با این وجود، علت دو سوم بیماریها مستقیماً مربوط به عوارض بیماری میباشد. .خودکشی به ویژه بسیار شایع است، این در حالی است که عفونتها و عوارض دیگر برای افراد ناتوان بسیار خطرناک میباشند. .اگرچه اکثر مبتلایان به این بیماری قبل از مرگ خود توانایی راه رفتن را از دست میدهند، با این حال ۹۰٪ بیماران توانایی راه رفتن بدون کمک دیگران را در ۱۰ سال اول بیماری دارند، و ۷۵٪ در ۱۵ سال اول بیماری. .
همهگیرشناسی
تا سال ۲۰۱۰ تعداد افراد مبتلا به اماس در جهان برابر با ۲٫۵–۲ میلوین نفر (حدوداً ۳۰ نفر از هر ۱۰۰٫۰۰۰ نفر) میباشد، که البته این میزان بسته به هر منطقه متفاوت میباشد. تخمینهای زده شده اینگونه میگویند که این بیماری در سال ۲۰۱۰ جان حدوداً ۱۸٫۰۰۰ انسان را گرفتهاست. .در آفریقا این میزان کمتر از ۰٫۵ نفر از هر ۱۰۰٫۰۰۰ نفر است، این در حالی است که این میزان در جنوب شرقی آسیا به ۸٫۳ نفر از هر ۱۰۰٫۰۰۰ نفر میرسد، و در اروپا این میزان ۸۰ نفر از هر ۱۰۰٫۰۰۰ نفر میباشد. .این میزان در برخی از نژادهای اروپای شمالی بیش از ۲۰۰ نفر از هر ۱۰۰٫۰۰۰ نفر است. .تعداد افراد جدیدی که به این بیماری مبتلا میشوند تقریباً برابر با ۲٫۵ نفر از هر ۱۰۰٫۰۰۰ نفر میباشد. . میزان افراد مبتلا به این بیماری در حال افزایش است، با این حال دلیل این افزایش را میتوان به سادگی از طریق تشخیصهای بهتر پیدا کرد. .مطالعات بسیاری بر روی الگوهای جمعیت و جغرافیایی انجام شدهاست.و به وجود آمدن تعدادی نظریه در خصوص علت این بیماری محصول این مطالعات بودهاست. . بیماری اماس اغلب خود را در بزرگسالان دراواخر دهه دوم زندگی یا اوایل دهه سوم نشان میدهد اما این بیماری میتواند در موارد نادری در دوران کودکی یا پس از ۵۰ سالگی بروز کند. . زیرگونه پیش رونده اولیه این بیماری در افراد بالای ۵۰ سال رایجتر است. .مانند بسیاری از اختلالات خود ایمنی، این بیماری در زنان رایجتر است، و ممکن است این میزان افزایش نیز یابد.تا سال ۲۰۰۸، میزان این بیماری در جهان در زنان دو برابر مردان میباشد.حتی در کودکان این بیماری در دختران بسیار بیشتر از پسران میباشد، این در حالی است که در افراد بالای پنجاه سال میزان این بیماری در زنان و مردان یکسان است.
موارد بیماری اماس در ایران بین سالهای ۲۰۰۸ تا ۲۰۱۵ و در هر ۱۰۰٫۰۰۰ نفر. ایران از نظر شیوع این بیماری رتبهٔ اول را در خاورمیانه دارد و آمارها نشان میدهد موارد ابتلا به این بیماری در حال افزایش است.
در ایران آمار مبتلایان به بیماری در سه دههٔ اخیر رو به افزایش بودهاست. به گفتهٔ سیدمحمد هادی ایازی قائممقام وزیر بهداشت، درمان و آموزش پزشکی در امور مشارکتهای اجتماعی در حالی که در سال ۱۳۵۶ فقط ۲۶ بیمار مبتلا به اماس در کشور شناسایی شده بودند، در حال حاضر ۶۰ هزار نفر در کشور مبتلا به اماس هستند. شیوع اماس در ایران ۵ تا ۷۴ نفر در هر ۱۰۰ هزار نفر برآورد شدهاست و استان اصفهان بالاترین میزان شیوع (۹۳ در هر ۱۰۰ هزار نفر) را به خود اختصاص دادهاست. ایران بیشترین مبتلایان به اماس را در منطقه دارد.
تاریخچه
تاریخچه پزشکی
عصبشناس فرانسوی، ژان مارتین شارکو (Jean-Martin Charcot) (۱۸۹۳–۱۸۲۵(اولین فردی بود که در سال ۱۸۶۸ به تصلب (عصبی) متعدد به عنوان یک بیماری مجزا پی برد. . شارکو به مدد گزارشهای پیشین و با اضافه کردن مشاهدات آسیب شناختی و بالینی خود نام این بیماری را "sclerose en plaques" گذاشت. علائم سهگانه این بیماری که اکنون به نام سهگانه ۱ شارکو شناخته میشوند عبارتند از جنبش غیرارادی کره چشم، رعشه هدفمند، و گفتار تلگرافی (گفتار مقطع (میباشند، اگرچه این علائم مختص بیماری اماس نمیباشند. شارکو همچنین متوجه تغییرات شناختی در بیماران خود شد که موجب به وجود آمدن "ضعف چشمگیر حافظه" و "کاهش قدرت ادراک" در آنها شده بود.
قبل از شارکو، رابرت کارسول (۱۸۵۷–۱۷۹۳) که استاد انگلیسی آسیبشناسی بود، و ژان کروویلهر(۱۸۷۳–۱۷۹۱)، که استاد فرانسوی آناتومی آسیب شناختی بود، بسیاری از جزئیات بالینی این بیماری را تشریح کرده و به تصویر درآورده بودند، اما نتوانسته بودند آن را به عنوان یک بیماری مجزا تشخیص دهند. بویژه، کارسول آسیبهایی که شناسایی کرده بود را «ضایعه ویژه ستون فقرات به همراه تحلیل بافت» نامید.در سال ۱۸۶۳ آسیبشناس سوئیسی جورج ادوارد رینفلیش (Georg Eduard Rindfleisch) (۱۹۰۸–۱۸۳۶) با استفاده از میکروسکوپ متوجه شد که ضایعات التهابی در اطراف رگهای خونی پخش میشدند.در قرن ۲۰ نظریههایی در خصوص علت و بیماریزایی این بیماری ارائه شد و درمانهای مؤثر این بیماری در دهه ۱۹۹۰ کشف شدند. .
موارد تاریخی بیماری
مطالعه تصویری حرکت یک زن مبتلا به اماس با مشکلات حرکتی که در سال ۱۸۸۷ توسط مایبریج انجام شدهاست.
گزارشهای تاریخی فراوانی از افرادی که قبل از تشریح بیماری توسط شارکو یا اندکی پس از آن زندگی میکردهاند و احتمالاً به بیماری اماس مبتلا بودهاند در دست وجود دارد. زن جوانی به نام هالدورا که در حدود قرن ۱۲ میلادی در ایسلند میزیسته بهطور ناگهانی بینایی و تحرک خود را از دست داد و هفت روز پس از اعتراف کردن به قدیسها دوباره آنها را بدست آورد. قدیس لیدوینا اهل اسخیدام، یک هلندیراهبه، که بین سالهای (۱۴۳۳–۱۳۸۰(میزیسته میتواند یکی از افرادی باشد که به بیماری اماس مبتلا بودهاست. از سن ۱۶ سالگی تا زمان مرگش یعنی تا سن ۵۳ سالگی، وی دچار دردهای مقطعی، سست شدگی پاها شده و بینایی خود را از دست داده بود— علائمی که نشانههای بیماری اماس میباشند. هر دو این موارد منجر به ارائه فرضیه «ژن وایکینگ» برای انتشار این بیماری شد.
آگوستوس فردریک دسته پسر شاهزاده آگوستوس فردریک، دوک ساسکس و بانو آگوستا مورای و نوهجورج سوم، که بین سالهای (۱۸۴۸–۱۷۹۴) میزیسته، تقریباً به یقین دچار اماس بودهاست. دسته یادداشتهایی مفصلی را از دوران ۲۲ ساله بیماری خود نوشتهاست. یادداشتهای وی از سال ۱۸۲۲ شروع میشوند و در سال ۱۸۴۶ پایان میپذیرد، با این حال دو سال پایانی زندگی وی نا معلوم ماندهاست. علائم بیماری وی از سن ۲۸ سالگی پس از مراسم خاک سپاری یکی از دوستانش با از دست دادن مقطعی بینایی خود (نابینایی فوگاکس) آغاز شد. در طول دورهٔ بیماری اش، وی دچار سستی در پاها، چلفتی دستها، سستی دستها، سر گیجه، اختلال در مثانه، و اختلال در نعوظ شدن شد. در سال ۱۸۴۴، وی شروع به استفاده از صندلی چرخ دار کرد. علیرغم بیماری اش، همواره نسبت به زندگی خوش بین بود.یکی دیگر از موارد اولیه اماس توسط شرح حالنویس بریتانیایی به نام دبیلیو ان پی باربلیون، نام مستعار بروس فردریک کامینگز که بین سالهای (۱۹۱۹–۱۸۸۹) میزیسته به ثبت رسیدهاست. وی شرح مفصلی از تشخیص پزشکی و تلاشهای خویش را به ثبت رسانیدهاست. شرح حال وی دز سال ۱۹۱۹ تحت عنوان «یادداشتهای یک مرد ناامید» به چاپ رسید.
